طبق پیشبینیها سلول درمانی، نسل بعدی محصولات درمانی مورد قبول در محیطهای کلینیکی خواهد بود. موضوعی که به آن داروهای زنده گفته میشود. این داروها پتانسیل پاسخ پویا و موقت به تغییرات را درحین فرایند تولیدشان در خارج بدن و همچنین بعد از ورود به بدن دارند. سلولهای T با قدرت بیان رسپتورهای آنتی ژنی کایمریک که به لحاظ ژنتیکی مهندسی شدهاند، به ابزارهایی قدرتمند برای کنترل قدرت مقابله سیستم ایمنی در برابر سرطان تبدیل گردیدهاند. سازمانهای قانونگذار، درمان به کمک سلولهای کارتی را بهدلیل اثر قابل توجهشان در درمان برخی از بدخیمیهای هماتولوژیکی پذیرفته اند.اگرچه مهندسی و تولید این سلولها همچنان بعنوان مانعی در مقابل پذیرش گسترده این تکنولوژی باقی مانده است. به کمک رویکردهای زیستمهندسی شامل بیومتریال، زیستشناسی مصنوعی، مهندسی متابولیک، کنترل فرآیند و اتوماسیون، و مدلسازی بیماری در داخل بدن امکان ارائه روشهای امیدوارکنندهای برای غلبه بر برخی از این چالشها وجود دارد.
ارکان اصلی درمان سرطان عمل جراحی، تابش، شیمی درمانی و پیوند سلولهای بنیادی خونساز (HSCT) هستند. در دو دهه گذشته، ایمندرمانی تبدیل به جایگزین مناسبی برای روشهای موجود شده است.ابتدا این روش، درمانهای آنتیبادی مونوکلونال و سیتوکینی را شامل میشد. در پنج سال اخیر، درمان به کمک سلول T با قدرت بیان رسپتور آنتی ژنی کایمریک (سلول کار تی) در حوزه ایمندرمانی سرطان توسعه یافته است. در این رویکرد، لنفوسیتهای تغییریافته ژنتیکی برای بیان یک رسپتور ساختگی جدید طراحی میشوند. این رسپتور ساختگی از یک بخش متغیر تک حلقهای که در خارج سلول بیان میشود و مربوط به یک آنتیبادی مونوکلونال است، تشکیل شده است. این بخش خارج سلولی از طریق یک رابط تراغشایی به 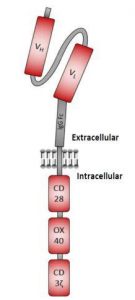
دامنه سیگنال درون سلولی رسپتورهای مشترک سلول T مشترک مانند
CD3 و CD28 متصل شده است (شکل 1). رسپتور آنتی ژنی کایمریک برای
هدف قراردادن آنتی ژنهایی که روی سطح سلولهای سرطان بیان میشوند،
قابل استفاده است. قسمت scFv رسپتور آنتیژن کایمریک مخصوص به یک
آنتیژن سطح است (بعنوان مثال، CD19، نشانگر ردهبندی سطح سلول B مورد استفاده برای هدف قرار دادن لنفوبلاستی حاد و لوسمی لنفوسیتی مزمن). قسمت scFv به CAR اجازه میدهد از برخوردهای متدوال بین TCR و مجموعه سازگاری بافتی اصلی جلوگیری کند. این امر موجب فعال شدن سلول جهت تشخیص آنتیژن هدف میشود.
فرآیند معمولی تولید CAR T Cell با برداشت سلولهای تک هستهای محیطی خون بیمار از طریق لوکفرزیس آغاز میشود.این سلولهای جداشده بوسیله ترانس ژن CAR منتقل و فعال میشوند. سپس قبل از بهکار گیری، در بیرون بدن (ex vivo) تحت تستهای کنترل کیفیت (QC) قرار میگیرند. کل فرآیند تولید حداقل 22 روز وقت نیاز داشته که با برداشت سلول T شروع و با انتقال درون وریدی سلولهای مهندسی شده CAR T به بیمار پایان مییابد (شکل 2).
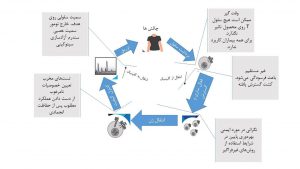
شکل2- چالشهای فرایند تولید CAR T Cells
در میان آزمایشهای منتشرشده درمورد بدخیمیهای هماتولوژیکی، این درمان منجر به بهبودیهای کامل یا جزئی، تقریبا در 70 تا 94 درصد بیماران در تمامی طرحهای CAR شده است. پذیرش درمان به کمک سلول CAR T در آزمایشهای بالینی شباهتهایی با توسعه اولیه پیوند مغز استخوان (BMT) نشان میدهد. اوایل با شک و ترید به BMT نگاه میشد و در تعداد معدودی از مراکز آکادمیک پیشنهاد شد. با آشکارشدن تاثیر آن، توجهات را به خود جلب کرد، و در حال حاضر در مراکز بیشتری در سراسر جهان در دسترس بوده و بیش از یک میلیون بار در سراسر جهان اجرا شده است.به طور مشابه، گردش کار کامل درمان و تولید سلول CAR T شامل انتقال ژن، کشت و مراقبت بالینی محدود به تعداد انگشتشماری از مراکز آکادمیکی است که اغلب با صنایعی با پتانسیلهای تولیدی و کلینیکی پیشرفته همکاری دارند (دانشگاه پنسیلوانیا با نواریتس، بیمارستان کودکان سیاتل و مرکز سرطان Sloan Kettering با Juno Therapeutics و چند مورد دیگر).
چالشهای بیولوژیکی متنوع، کاربرد گسترده کلینیکی درمان به کمک سلول CAR T را محدود کرده است. اول اینکه، درمانهای به کمک سلول CAR T تا به امروز فقط برای بدخیمیهای هماتولوژیکی خاصی از خود کارایی نشان دادهاند و همچنان مشکلاتی وجود دارد. فرآیند درمان بهدلیل عوارض جانبی شدید مانند سندرم آزادسازی سیتوکین و صدمه به سیستم عصبی با پیچیدگیهای زیادی مواجه است. این مسائل نگرانیهای قابلتوجهی را ایجاد میکند، اگرچه که گزینههای استاندارد درمان نیز مثل شیمی درمانی و HSCT به طور مشابه اثرات جانبی شدیدی مانند سمیت حاد و خطر ابتلا به بیماری پروستات (GVHD) دارند. بعلاوه، تلاشهای اخیر برای درمان تومورهای جامد با سلولهای CAR T نتایج ناامیدکنندهای کسب کردهاند. بعضا این نتایج به دلیل تعداد ناهمگون سلولهای CAR T که بهصورت متناقض عمل کردهاند و در بعضی موارد نتوانستهاند درون بدن بمانند، به دست آمدهاند. این موضوع اثبات کرده است که ما با چالشی برای یافتن آنتیژنهای هدف مناسب برای تومورهای جامد و همچنین برای یافتن استراتژیهای موردنیاز برای بهبود نفوذ سلول T درون محیط تومور مواجه هستیم. علاوه بر این، فرسودگی و تفکیک سلول T باعث کمبود استقامت و ماندگاری سلول در بدن میشوند. درحالیکه مشکلاتی که در درجه اول از بیولوژی سلول T بوجود آمده بودند، در حال حاضر حل شدهاند، اما همچنان نیاز به بهبود پارادایمها و فرآیندهای تولید برای تضمین استفاده گسترده درمان به کمک سلول CAR T وجود دارد.


